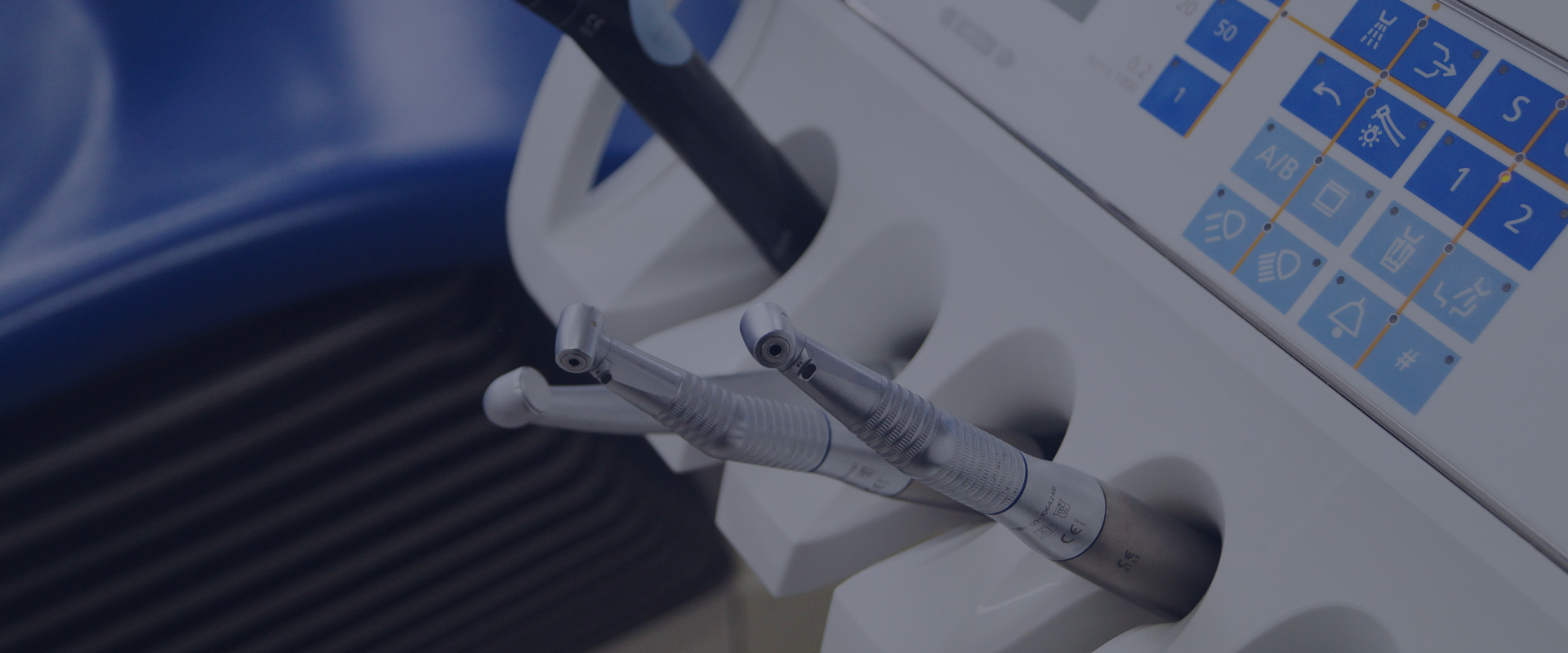
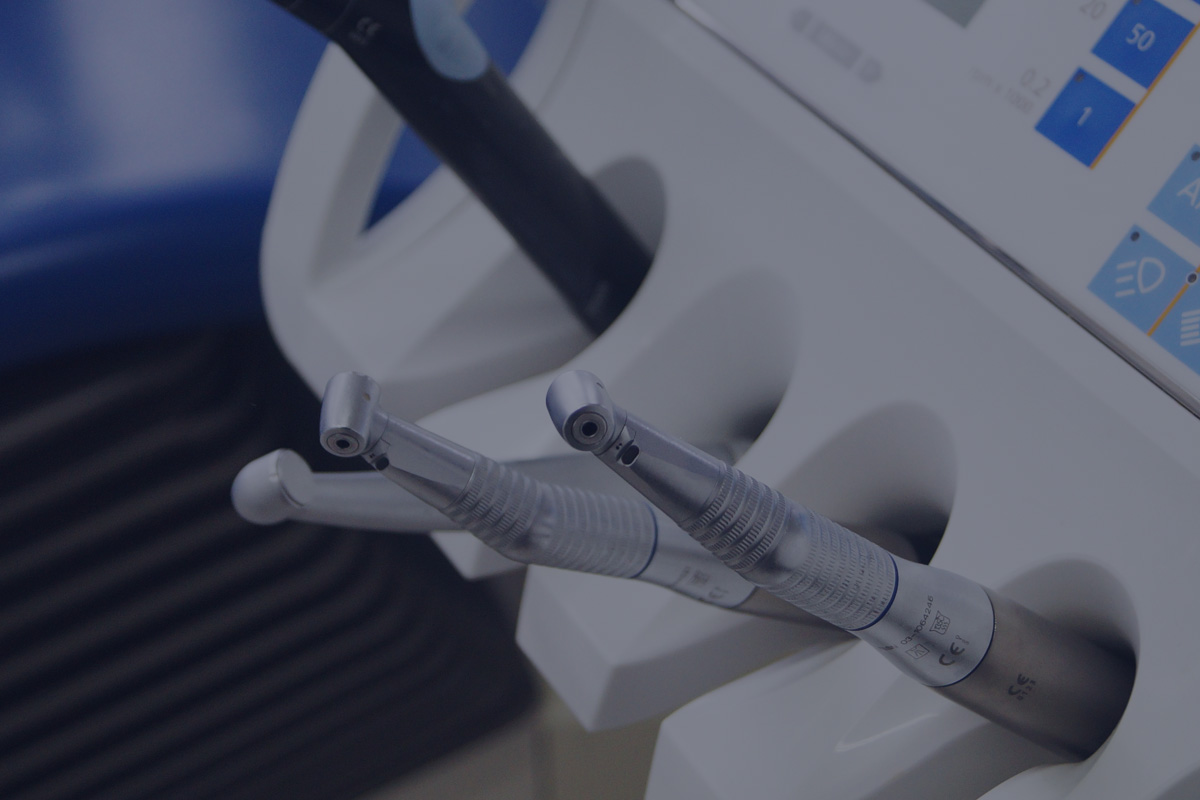
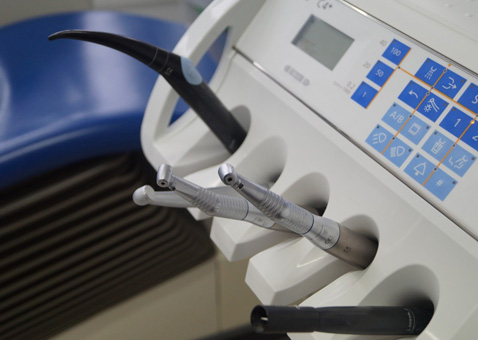
•生物相容性
安全性评估研究(体外和体内)即通过对各种生物材料、医疗器械和相关产品的测试来确定产品是否存在有毒物质以及其他潜在的负面影响。生物相容性的测试范围包括新材料的初筛、产品发布测试、定期审查测试以及非临床或上市前期安全性评估,以确保受试对象符合当前的NMPA、FDA 和其他国际标准。
明择提供对产品的组成材料或终产品的评估测试,来检验其预期用途是否符合生物相容性。我们会利用各种生物模型来检验测试材料或其相应的浸提液。明择开展的安全性评估项目均遵循GB/T16886、FDA 指导原则以及ISO 10993 标准。
用于确定生物效应的主要测试类别包括:
•细胞毒性 •致敏性 •皮内刺激 •急性系统毒性 •亚慢毒性 •遗传毒性 •植入 •血液相容性试验 •慢性毒性 •致癌性 •生殖与发育 •生物降解
优势:1.一份报告多国通用
2.报告获得审批机构(FDA,NMPA,NB,PMDA)的认可